2da Ley de la Termodinámica. Entropía
Esta ley arrebata la dirección en la que deben llevarse a cabo los procesos termodinámicos y, por lo tanto, la imposibilidad de que ocurran en el sentido contrario (por ejemplo, que una mancha de tinta dispersada en el agua pueda volver a concentrarse en un pequeño volumen). También establece, en algunos casos, la imposibilidad de convertir completamente toda la energía de un tipo en otro sin pérdidas. De esta forma, la segunda ley impone restricciones para las transferencias de energía que hipotéticamente pudieran llevarse a cabo teniendo en cuenta sólo el Primer Principio. Esta ley apoya todo su contenido aceptando la existencia de una magnitud física llamada entropía, de tal manera que, para un sistema aislado (que no intercambia materia ni energía con su entorno), la variación de la entropía siempre debe ser mayor que cero.
Debido a esta ley también se tiene que el flujo espontáneo de calor siempre es unidireccional, desde los cuerpos de mayor temperatura hacia los de menor temperatura, hasta lograr un equilibrio térmico.
La aplicación más conocida es la de las máquinas térmicas, que obtienen trabajo mecánico mediante aporte de calor de una fuente o foco caliente, para ceder parte de este calor a la fuente o foco o sumidero frío. La diferencia entre los dos calores tiene su equivalente en el trabajo mecánico obtenido.
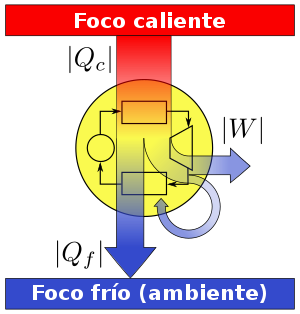
La máquina de Carnot
Es una MT ideal basada en un ciclo reversible ideal de tal forma que su eficiencia delimita la eficiencia de una MT real, trabajando entre los mismos focos de temperatura,
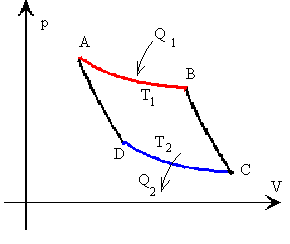
El ciclo reversible ideal que usa la MT de Carnot se denomina ciclo de Carnot y esta constituido por dos procesos adiabáticos y 2 isotérmicos, tal como la representa el diagrama p-V siguiente,
Se define ciclo de Carnot como un proceso cíclico reversible que utiliza un gas perfecto, y que consta de dos transformaciones isotérmicas y dos adiabáticas, tal como se muestra en la figura.
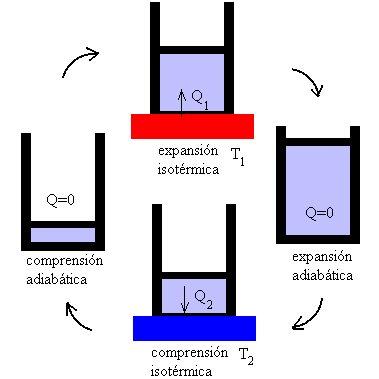
La representación gráfica del ciclo de Carnot en un diagrama p-V es el siguiente
Tramo B-C adiabática
Tramo C-D isoterma a la temperatura T2
Tramo D-A adiabática
En cualquier ciclo, tenemos que obtener a partir de los datos iniciales:
· La presión, volumen de cada uno de los vértices.
· El trabajo, el calor y la variación de energía interna en cada una de los procesos.
· El trabajo total, el calor absorbido, el calor cedido, y el rendimiento del ciclo.
Los datos iniciales son los que figuran en la tabla adjunta. A partir de estos datos, hemos de rellenar los huecos de la tabla.
| Variables |
A
|
B
|
C
|
D
|
| Presión p (atm) | pA | |||
| Volumen v (litros) | vA | vB | ||
| Temperatura T (K) | T1 | T1 | T2 | T2 |
Para obtener las variables y magnitudes desconocidas emplearemos las fórmulas que figuran en el cuadro-resumen de las transformaciones termodinámicas.
- Transformación A->B (isoterma) La presión pB se calcula a partir de la ecuación del gas ideal
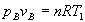
Variación de energía interna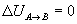
Trabajo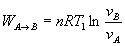
Calor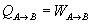
- Transformación B->C (adiabática) La ecuación de estado adiabática es
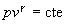 o bien,
o bien, 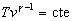 . Se despeja vc de la ecuación de la adiabática
. Se despeja vc de la ecuación de la adiabática 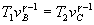 . Conocido vc y T2 se obtiene pc, a partir de la ecuación del gas ideal.
. Conocido vc y T2 se obtiene pc, a partir de la ecuación del gas ideal. 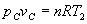 .
.
Calor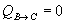
Variación de energía interna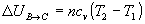
Trabajo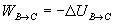
- Transformación C->D (isoterma) Variación de energía interna
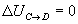
Trabajo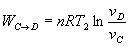
Calor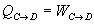
- Transformación D-> A (adiabática)
Se despeja vD de la ecuación de la adiabática. Conocido vD y T2 se obtiene pD, a partir de la ecuación del gas ideal.
.
Calor
Variación de energía interna
Trabajo
- Variación de energía interna
En un proceso cíclico reversible la variación de energía interna es cero
- Trabajo
Los trabajos en las transformaciones adiabáticas son iguales y opuestos. A partir de las ecuaciones de las dos adiabáticas, la relación entre los volúmenes de los vértices es, lo que nos conduce a la expresión final para el trabajo.
- Calor
En la isoterma T1 se absorbe calor Q>0 ya que vB>vA de modo queEn la isoterma T2 se cede calor Q<0 ya que vD<vC
- Rendimiento del ciclo
Se define rendimiento como el cociente entre el trabajo realizado y el calor absorbido


Harrah's Atlantic City - JCM Hub
ResponderEliminarHarrah's 전주 출장샵 AC 오산 출장샵 Casino & Hotel is 아산 출장마사지 located in the heart 서울특별 출장안마 of Atlantic City, NJ and provides casino entertainment 나주 출장안마 for the greater Philadelphia region,