Conservación de la energía, 1ra Ley de la Termodinámica
También conocida como principio de conservación de la energía para la termodinámica «en realidad el primer principio dice más que una ley de conservación», establece que si se realiza trabajo sobre un sistema o bien éste intercambia calor con otro, la energía interna del sistema cambiará. Visto de otra forma, esta ley permite definir el calor como la energía necesaria que debe intercambiar el sistema para compensar las diferencias entre trabajo y energía interna. Fue propuesta por Nicolas Léonard Sadi Carnot en 1824, en su obra Reflexiones sobre la potencia motriz del fuego y sobre las máquinas adecuadas para desarrollar esta potencia, en la que expuso los dos primeros principios de la termodinámica. Esta obra fue incomprendida por los científicos de su época, y más tarde fue utilizada por Rudolf Loreto Clausius y Lord Kelvin para formular, de una manera matemática, las bases de la termodinámica.
La ecuación general de la conservación de la energía es la siguiente:


Esta última expresión es igual de frecuente encontrarla en la forma ∆U = Q + W. Ambas expresiones, aparentemente contradictorias, son correctas y su diferencia está en que se aplique el convenio de signos IUPAC o el Tradicional (véase criterio de signos termodinámico).
Procesos térmicos importantes.
Procesos Iso
Son los procesos cuyas magnitudes permanecen "constantes", es decir que el sistema cambia manteniendo cierta proporcionalidad en su transformación.
Se les asigna el prefijo iso-.
Proceso isotérmico
 Se denomina proceso isotérmico o proceso isotermo al cambio de temperatura reversible en un sistema termodinámico, siendo dicho cambio de temperatura constante en todo el sistema. La compresión o expansión de un gas ideal en contacto permanente con un termostato es un ejemplo de proceso isotermo, y puede llevarse a cabo colocando el gas en contacto térmico con otro sistema de capacidad calorífica muy grande y a la misma temperatura que el gas; este otro sistema se conoce como foco caliente. De esta manera, el calor se transfiere muy lentamente, permitiendo que el gas se expanda realizando trabajo. Como la energía interna de un gas ideal sólo depende de la temperatura y ésta permanece constante en la expansión isoterma, el calor tomado del foco es igual al trabajo realizado por el gas: Q = W
Se denomina proceso isotérmico o proceso isotermo al cambio de temperatura reversible en un sistema termodinámico, siendo dicho cambio de temperatura constante en todo el sistema. La compresión o expansión de un gas ideal en contacto permanente con un termostato es un ejemplo de proceso isotermo, y puede llevarse a cabo colocando el gas en contacto térmico con otro sistema de capacidad calorífica muy grande y a la misma temperatura que el gas; este otro sistema se conoce como foco caliente. De esta manera, el calor se transfiere muy lentamente, permitiendo que el gas se expanda realizando trabajo. Como la energía interna de un gas ideal sólo depende de la temperatura y ésta permanece constante en la expansión isoterma, el calor tomado del foco es igual al trabajo realizado por el gas: Q = W
Una curva isoterma es una línea que sobre un diagrama representa los valores sucesivos de las diversas variables de un sistema en un proceso isotermo. Las isotermas de un gas ideal en un diagrama P-V, llamado diagrama de Clapeyron, son hipérbolas equiláteras, cuya ecuación es P•V = constante.
Proceso isocórico
Proceso isocórico
Un proceso isocórico, también llamado proceso isométrico o isovolumétrico es un proceso termodinámico en el cual el volumen permanece constante; ΔV = 0. Esto implica que el proceso no realiza trabajo presión-volumen, ya que éste se define como ΔW = PΔV, donde P es la presión (el trabajo es positivo, ya que es ejercido por el sistema).
Aplicando la primera ley de la termodinámica, podemos deducir que ΔU, el cambio de la energía interna del sistema es:
ΔU = Q para un proceso isocórico: es decir, todo el calor que transfiramos al sistema se sumará a su energía interna, U. Si la cantidad de gas permanece constante, entonces el incremento de energía será proporcional al incremento de temperatura,
para un proceso isocórico: es decir, todo el calor que transfiramos al sistema se sumará a su energía interna, U. Si la cantidad de gas permanece constante, entonces el incremento de energía será proporcional al incremento de temperatura,
Q = nCVΔT
donde CV es el calor específico molar a volumen constante. En un diagrama P-V, un proceso isocórico aparece como una línea vertical
Proceso isobárico es aquel proceso termodinámico que ocurre a presión constante. En él, el calor transferido a presión constante está relacionado con el resto de variables.
Proceso isobárico
Proceso isobárico es aquel proceso termodinámico que ocurre a presión constante. En él, el calor transferido a presión constante está relacionado con el resto de variables.La Primera Ley de la Termodinámica, para este caso, queda expresada como sigue:
Donde:
 = Calor transferido.
= Calor transferido. = Energía Interna.
= Energía Interna.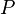 = Presión.
= Presión. = Volumen.
= Volumen.
En un diagrama P-V, un proceso isobárico aparece como una línea horizontal.
Proceso adiabático
 En termodinámica se designa como proceso adiabático a aquel en el cual el sistema (generalmente, un fluido que realiza un trabajo) no intercambia calor con su entorno. Un proceso adiabático que es además reversible se conoce como proceso isentrópico. El extremo opuesto, en el que tiene lugar la máxima transferencia de calor, causando que la temperatura permanezca constante, se denomina como proceso isotérmico. El término adiabático hace referencia a elementos que impiden la transferencia de calor con el entorno. Una pared aislada se aproxima bastante a un límite adiabático. Otro ejemplo es la t
En termodinámica se designa como proceso adiabático a aquel en el cual el sistema (generalmente, un fluido que realiza un trabajo) no intercambia calor con su entorno. Un proceso adiabático que es además reversible se conoce como proceso isentrópico. El extremo opuesto, en el que tiene lugar la máxima transferencia de calor, causando que la temperatura permanezca constante, se denomina como proceso isotérmico. El término adiabático hace referencia a elementos que impiden la transferencia de calor con el entorno. Una pared aislada se aproxima bastante a un límite adiabático. Otro ejemplo es la t
emperatura adiabática de llama, que es la temperatura que podría alcanzar una llama si no hubiera pérdida de calor hacia el entorno. En climatización los procesos de humectación (aporte de vapor de agua) son adiabáticos, puesto que no hay transferencia de calor, a pesar que se consiga variar la temperatura del aire y su humedad relativa. El calentamiento y enfriamiento adiabático son procesos que comúnmente ocurren debido al cambio en la presión de un gas. Esto puede ser cuantificado usando la ley de los gases ideales.
Procesos politrópicos
Los procesos politrópicos son aquellos procesos termodinámicos para gases ideales que cumplen con la ecuación: PVa = cte. donde a es un número dado. Para el caso de procesos adibáticos, a es igual a k, el cual es un valor específico para cada sustancia. Este valor se puede encontrar en tablas para dicho caso.

 ,
,
No hay comentarios:
Publicar un comentario